中悪理科「イオン化傾向」です。金属は陽イオンになりやすい。この性質を金属のイオン化傾向という。このイオン化傾向について詳しくみていきます。
金属のイオン化傾向
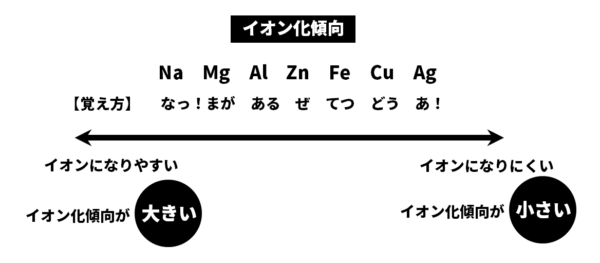
金属は電解質の溶液に接すると、陽イオンとなって溶液中にとけこむ性質がある。この性質を金属のイオン化傾向という。その強さは金属の種類によって異なり、金属をイオン化傾向の大きさの順にならべたものをイオン化列(電気化学列)という。
イオン化傾向と化学的性質
- 一般に、イオン化傾向の小さい金属ほど化学的に安定である。
- イオン化傾向の大きい金属ほど酸化されやすい。還元する力が大きい。
- 酸に対する性質として水素よりイオン化傾向の大きい金属は、酸の水素イオンH+に電子をあたえて水素を発生させる。 (例)Zn + 2H+ → Zn2+ + H2
- 水との反応としてイオン化傾向の特に大きいK、Ca、Naなどは、水と反応して水素を発生させる。(例)2H2O + 2Na → 2Na+ + 2OH– + H2
金属イオンと金属の反応
イオン化傾向の小さい金属のイオンを含む水溶液に、それよりイオン化傾向の大きい金属を入れると、イオン化傾向の大きい金属は電子を失って陽イオンとなり、かわりにイオン化傾向の小さい金属のイオンがその電子を受け取って原子になって析出する。
イオンにならない原子
原子には、イオンになりやすいものがある一方でなりにくいものもある。
- イオンになりにくい原子:炭素(C)・ケイ素(Si)・窒素 (N)・リン(P)など。
- イオンにならない原子:ヘリウム(He)・ネオン(Ne)・アルゴン(Ar)・クリプトン (Kr)・キセノン(Xe)・ラドン(Rn)など。



コメント