【中2理科】熱による分解の要点まとめです。
熱による分解の要点
熱分解は、物質を熱によって分解する実験を行い、1種類の物質から2種類以上の元の物質とは異なる物質が生成すること。
・物質が熱分解して、生成した物質が元の物質とは異なることを理解しましょう。
・物質を熱分解し、化学変化の前後の物質の性質を比べる実験における注意点を確認しましょう。
・生成した物質の確認方法まで覚えましょう。
酸化銀の熱分解
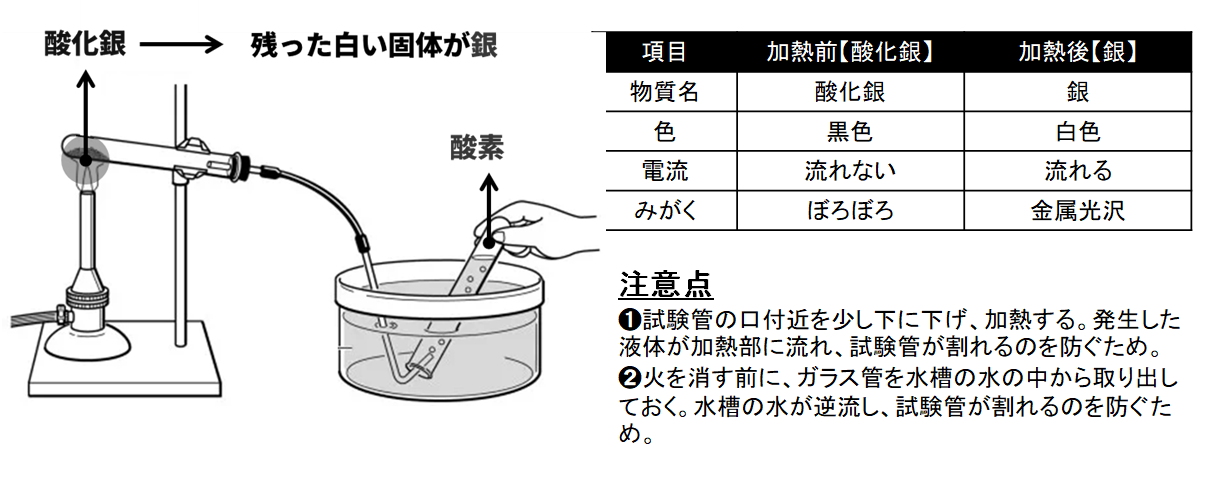
酸化銀は、黒色の粉末で、熱すると酸素が発生し、白色の銀ができる。銀河金属であることは、試験管の底でこすると金属光沢が出ることやたたくとのびることからわかります。
- 酸化銀→銀+酸素
- Ag2O→Ag+O2
<金属の性質>
- みがくと光を受けて輝く(金属光沢)
- たたくと広がり(展性)
- 引っ張ると伸びる(延性)
- 電流が流れやすい
- 熱が伝わりやすい
酸化銀の熱分解の実験の注意点
- 試験管の口付近を少し下に下げ、加熱する。発生した液体が加熱部に流れ、試験管が割れるのを防ぐため。
- 火を消す前に、ガラス管を水槽の水の中から取り出しておく。水槽の水が逆流し、試験管が割れるのを防ぐため。
酸化銀と銀の比較
| 項目 | 加熱前 | 加熱後 |
|---|---|---|
| 物質名 | 酸化銀 | 銀 |
| 色 | 黒色 | 白色 |
| 電流 | 流れない | 流れる |
| みがく | ぼろぼろ | 金属光沢 |
炭酸水素ナトリウムの熱分解
白い粉末の炭酸水素ナトリウムを熱すると、試験の口に液体の水がたまり、気体の二酸化炭素が発生します。試験管に残った粉末は、炭酸ナトリウムです。
炭酸水素ナトリウム→炭酸ナトリウム(白色の粉末)+水(液体)+二酸化炭素(気体)
【化学反応式】2NaHCO3 → Na2CO3 + H2O + CO2
- 炭酸水素ナトリウム…水に少し溶ける・弱いアルカリ性
- 炭酸水ナトリウム…水によく溶ける・強いアルカリ性・
- 水…青色の塩化コバルト紙が赤色になる。
- 二酸化炭素…石灰水が白くにごる。
試験管の操作の注意点
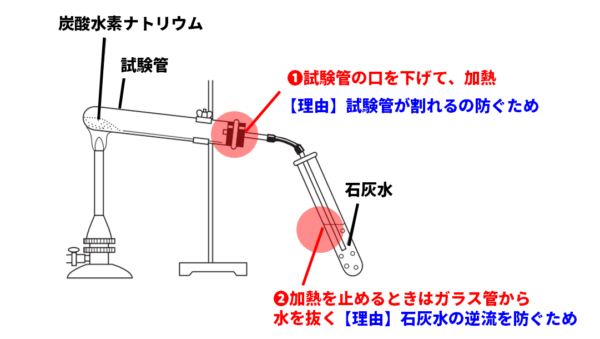
過熱した試験管の底に水が流れ込むと、急に冷やされて割れる恐れがあるため、次の2点に注意します。
- 加熱中、試験管の口は少し下げる。
- 火を消す前に、石灰水からガラス管を抜く。
炭酸水素ナトリウムと炭酸ナトリウムの比較
| 項目 | 加熱前の物質 | 加熱後の物質 |
|---|---|---|
| 物質名 | 炭酸水素ナトリウム | 炭酸ナトリウム |
| 水への溶け方 | 水に少し溶ける | 水によく溶ける |
| フェノールフタレイン液 | 薄い赤色 | 濃い赤色 |
| 水溶液の性質 | 弱いアルカリ性 | 強いアルカリ性 |
【確認】カルメ焼きの断面に、小さな穴がたくさんあいているのは、炭酸水素ナトリウムの熱分解の結果である。
炭酸アンモニウムの熱分解
炭酸アンモニウムの熱分解では、炭酸アンモニウムを加熱して、生じる気体を上方置換で捕集する。
- 炭酸アンモニウム→アンモニア+二酸化炭素+水
- 上方置換法…上方置換法で集める気体は、水に溶けやすく空気よりも軽い(密度が小さい)という性質があります。
アンモニアの発生の確認方法
- 捕集した気体に水を加えると、よくとけること、その水溶液を赤色リトマス紙につけると青くなることからアンモニアが発生したことがわかる。
- 炭酸アンモニウムを加熱しはじめると、すぐにアンモニ ア特有の刺激臭がすることからも、アンモニアが発生したことがわかる。
<アンモニアの性質>
- より軽い…空気の密度の約0.6倍。
- 刺激臭がある…粘膜を強く刺激するので、目、鼻。口に直接触れないようにする。
- 水によくとける…20°Cで、水1cm3に約760cm3とける。とけた水溶液はアルカリ性を示す。
- 塩化水素と反応して白煙を生じる…濃アンモニア水に、濃塩酸を近づけると、白煙が生じる。
二酸化炭素の発生の確認方法
捕集した気体に石灰水を加えると白くにこる。
<二酸化炭素の性質>
- 化学式…CO2
- 色や臭い…無色無臭
- 水への溶け方…少し溶ける 水に溶けると酸性の炭酸水になる
- 重さ…空気より重い
- 集め方…水上置換法か下方置換法
水の発生
加熱に用いた試験管の口付近にたまった液体を青色の塩化コバルト紙につけると赤くなる。


コメント