【中3理科】化学変化とイオンの要点まとめ・確認問題です。
化学変化とイオンの要点
原子の構造
電子的に中性な原子が-の電気をもつ電子を放出すること陽イオンに、電子をうけとると陰イオンになります。
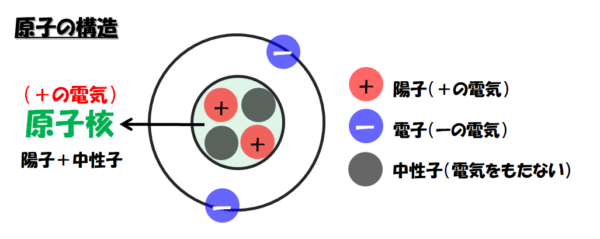
原子の構造は、中心に+の電気をもった原子核が1個あり、そのまわりを-の電気をもった電子がいくつか回っています。原子核は+の電気をもつ陽子と、電気をもたない中性子からなります。原子の中では、陽子の数と電子の数が等しいため、原子全体では電気をもちません。
イオン式は、イオンの記号を表したもの。原子の記号の右肩に、やりとりした電子の数と電気の+、-の符号で示します。
電離
塩酸中での塩化水素の電離
- 塩化水素→水素イオン+塩化物イオン
- HCl→H++Cl–
塩化銅水溶液中での塩化銅の電離
- 塩化銅→銅イオン+塩化物イオン
- CuCl2→Cu2++2Cl–
イオンの一覧
| 1価の陽イオン | イオン式 |
| 水素イオン | H+ |
| ナトリウムイオン | Na+ |
| アンモニウムイオン | NH4+ |
| 2価の陽イオン | イオン式 |
| 銅イオン | Cu2+ |
| マグネシウムイオン | Mg2+ |
| 亜鉛イオン | Zn2+ |
| バリウムイオン | Ba2+ |
| 1価の陰イオン | イオン式 |
| 塩化物イオン | Cl– |
| 水酸化物イオン | OH– |
| 硝酸イオン | NO3– |
| 2価のイオン | イオン式 |
| 炭酸イオン | CO32- |
| 硫化物イオン | S2- |
| 硝酸イオン | SO42- |
塩化銅水溶液の電気分解
塩化銅水溶液に炭素棒を入れ、電流を流す。すると陽極の炭素棒の表面からは、鼻をさすような刺激臭のある塩素が発生します。また、陰極の炭素棒の表面には、赤褐色の物質である銅が付着します。
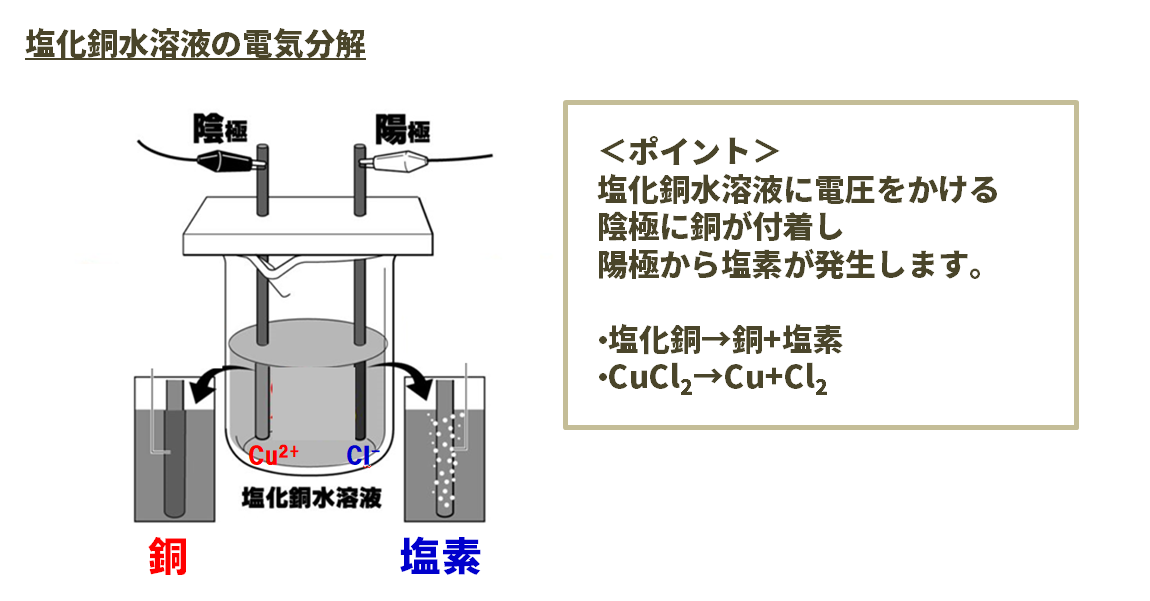
<ポイント>
塩化銅水溶液に電圧をかけると、陰極に銅が付着し、陽極から塩素が発生します。
- 塩化銅→銅+塩素
- CuCl2→Cu+Cl2
【比較】塩化銅水溶液と塩酸の電気分解の結果
| 塩化銅水溶液 | 塩酸 | |
|---|---|---|
| 化学変化 | 塩化銅→銅+塩素 | 塩化水素→水素+塩素 |
| 化学反応式 | CuCl2→Cu+Cl2 | 2HCl→H2+Cl2 |
| 陽極での変化 | 塩素が発生する | 塩素が発生する |
| 陰極での変化 | 銅が付着する | 水素が発生する |
【考察】塩化銅水溶液の電気分解
■ 塩素
においをかぐと鼻をさすにおい。鼻をさすにおいとは、さらし粉、インキ消し、プールの消毒薬などのにおいです。有毒な期待なので、実験操作上、注意が必要です。
- においをかぐときは、手であおいでかく。
- においを深く吸い込んない。
- 室内の喚起を十分に行う。
■ 銅
塩化銅水溶液の電気分解では、電極が乾いて表面から布でこすったり、電極に付着した物質を白紙の上に落とし、試験管の底でこすったりすると、金属光沢が出てくることでわかる。
注意銅は、磁石を近づけても反応しません。
■ 金属の性質
鉄や銅などの金属は次の性質があります。金属でない物質(非金属)と区別できます。
- みがくと光を受けて輝く(金属光沢)
- たたくと広がり(展性)
- 引っ張ると伸びる(延性)
- 電流が流れやすい
- 熱が伝わりやすい
磁石にくっつくのは、金属共通の性質ではありいません。鉄は磁石につくが、銅、アルミニウムはつきません。
化学電池
電池の発見は、1800年、イタリアの科学者ボルタが、銅と亜鉛、食塩水を使った電池をつくりました。
- 化学電池…化学エネルギーを電気エネルギーに変えるしくみです。電解質の水溶液に2種類の金属を入れると化学電池ができます。
- 備長炭電池…食塩水に木炭(備長炭)とアルミニウムはくを組み合わせた木炭電池で長時間電流を取り出すと、アルミニウムはくが化学変化でぼろぼろになります。
電流をとりだす実験
いろいろな金属と食塩水で電流が取り出せるか調べる実験です。
<手順>
- 食塩水に銅板と亜鉛版を入れ回路を組み立てて、電子オルゴールが鳴るかどうか調べます。
- オルゴールの+と-を逆につなぎ、鳴るかどうかを調べます。
- 金属の組み合わせをかえて、オルゴールの鳴り方を調べます。
<結果>
| +極 | -極 | オルゴールの鳴り方 |
| 銅 | 亜鉛 | 曲とわかる遅く弱い |
| 銅 | マグネシウム | はっきりと曲が聞こえた |
| 亜鉛 | マグネシウム | 音はするが曲にはならない |
- 2で、つなぎ方を逆にすると鳴らない。
- 3で、銅板と銅板など、同じ種類の金属板を使うと鳴らない。
<考察>
食塩水に2種類の金属を入れると、電子オルゴールが鳴るので、電池になったとわかります。
用いる金属がどちらの極になるかは、金属の組み合わせによって変わります。
電池とイオン
電池をつくって電極の変化を調べる。
<手順>
- 回路をつくり、プロペラが回るか調べます。
- しばらくモーターを回転させ、金属板の変化を調べます。
<結果>
- -極の亜鉛版は溶けだし、+極の銅板からは気体が発生しました。実験後、亜鉛版を観察すると、水溶液につかっていた部分は、表面がざらついているのがわかりました。
<考察>
- 電流が流れているとき、電池の内部では化学変化が起こっています。
電極で起こる化学変化
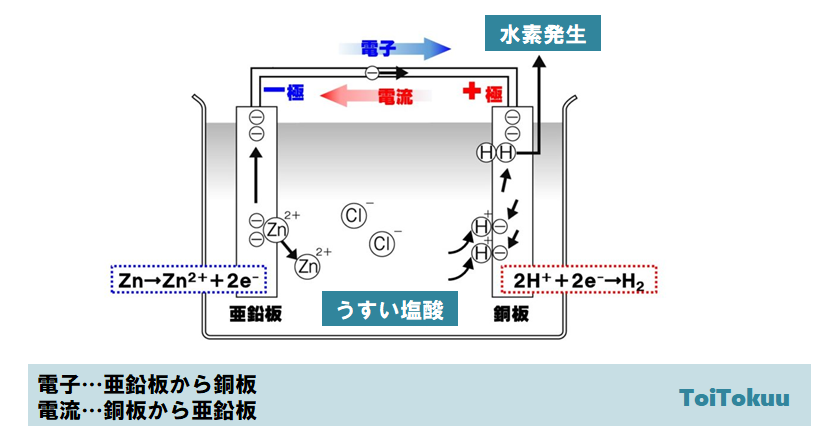
電池を取り出す実験
うすい塩酸に銅板と亜鉛版を入れた電池についてです。
<経過>
- 亜鉛は、2個の電子を失って亜鉛イオンZn2+となり、うすい塩酸中に溶けだしていきます。
- 亜鉛板に残された電子は、銅線をとって銅板へ向かって流れます。
- 銅板の表面では、塩化水素に電離によって生じた水溶液中の水素イオンH+が、導線から流れてくる電子を1個受け取って水素原子となります。水素原子は2個結びいて水素分子となり水素が発生します。
<結果>
うすい塩酸に銅板と亜鉛版を入れると、電子は亜鉛版から導線を通って銅板という向きに流れますが、電流の向きはその逆向きと決められているので、銅板から亜鉛版という向きに電流が流れることになります。したがって。銅板が+極、亜鉛版が-極になります。
燃料電池
燃料電池は、燃料が酸化される化学変化から、電気エネルギーを取り出すしくみです。燃料の水素を供給すれば、継続して電気をエネルギーを取り出せます。
酸・アルカリ
酸性とアルカリ性は酸、酸性の水溶液とアルカリ性の水溶液は、それぞれ次のような共通の性質ももちます。
| 青色リトマス紙 | 赤色リトマス紙 | BTB液 | マグネシウムリボン | |
|---|---|---|---|---|
| 酸性 | 赤色に変化させる | 変化しない | 黄色になる | 水素が発生する |
| 中性 | 変化しない | 変化しない | 緑色になる | 変化しない |
| アルカリ性 | 変化しない | 青色に変化させる | 青色になる | 変化しない |
酸性とアルカリ性とイオン
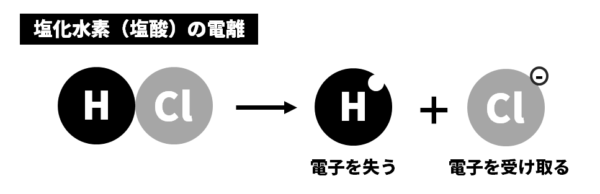
酸やアルカリが電離するときのようす
<酸の電離(水素イオンH+が生じる)>
| 様子 | イオン式 | |
|---|---|---|
| 塩酸の電離 | 塩酸→水素イオン+塩化物イオン | HCl→H++Cl– |
| 硝酸の電離 | 硝酸→水素イオン+硝酸イオン | H2SO4→2H++SO42- |
<アルカリの電離(水酸化物イオンOH–を生じる)>
| 様子 | イオン式 | |
|---|---|---|
| 水酸化ナトリウムイオンの電離 | 水酸化ナトリウム→ナトリムイオン+水酸化物イオン | NaOH→Na++OH– |
| 水酸化カリウムの電離 | 水酸化カリウム→カリウムイオン+水酸化物イオン | KOH→K++OH– |
| 水酸化バリウムの電離 | 水酸化バリウム→バリウムイオン+水酸化物イオン | Ba(OH)2→Ba2++2OH– |

酸性やアルカリ性の度合いを表す数値。pHは7が中性で、値が小さいほど酸性が強く、大きいほどアルカリ性が強いです。
中和と塩
塩酸と水酸化ナトリウム水溶液の混合において、塩酸に水酸化ナトリウム水溶液を混ぜていくと、水溶液の酸性がしだいに弱まります。中性になった水溶液を蒸発させると、白い血しょう(塩化ナトリウム)が現れます。
塩は、塩化ナトリウムのように、酸の陰イオンとアルカリの陽イオンが結びついている物質。
中和は、酸とアルカリが互いの性質を打ち消しあい、塩と水が生じる化学変化。
- 酸+アルカリ→塩+水
中和では、酸の水素イオンとアルカリの水酸化物イオンが結びついて、水が生成する。中和は熱を発生する発熱反応です。
- H++OH–→H2O
中和が起こるとき、酸とアルカリの種類がちがうと、できる塩の種類も変わります。
水に溶けやすい塩ができる中和
塩は、蒸発や再結晶によって取り出します。
| HCl+NaOH→NaCl+H2O | 塩化水素+水酸化ナトリウム→塩化ナトリウム+水 |
| HNO3+KOH→KNO3+H2O | 硝酸+水酸化ナトリウム→硝酸カリウム+水 |
水に溶けにくい塩ができる中和
塩は沈殿になります。
| H2SO4+Ba(OH)2→BaSO4+2H2O | 硝酸+水酸化バリウム→硝酸バリウム+水 |
| H2CO3+Ca(OH)2→CaCO2+2H2O | 炭酸+水酸化カルシウム→炭酸カルシウム+水 |
水酸化ナトリウム(NaOH)
水酸化ナトリウムは、白色の固体で潮解性です。空気中の水分を吸収してとけていく性質を潮解性という。そのため、水酸化ナトリウムの質量をはかりとるときは、すばやく行う必要がある。
水酸化ナトリウムの溶解度
水に溶解するときに、多量の発熱が起こる溶解度は非常に高く、100gの水に20°Cで100g、100°Cで347g溶解する。水溶液は強いアルカリ性を示し、タンパク質だけでなく、植物繊維(セルロース)もとかす場合がある。この性質があるため、濃い水酸化ナトリウム水溶液は、木材バルブを溶解してレーヨンを生成するときに用いられる。
- 溶解度…水100gに溶ける物質の質量のことです。物質の種類によっても変わりますし、水の温度によっても変化します。
苛性ソーダ
水酸化ナトリウムは、ガラスをとかすほど激しくほかの物質と反応するので、苛性ソーダとよばれる場合がある。ソーダとは、もともと炭酸ナトリウムのことだったのですが、それがナトリウムをふくむ物質すべてを意 味するようになったために、こうよばれます。漢字を当てて、苛性曹達と記される場合もある。
炭酸水素ナトリウム
二酸化炭素を吸収して、炭酸ナトリウムを生じる二酸化炭素が多量に存在する場合は、炭酸水素ナトリウムとなる。
- 炭酸水素ナトリウム…私たちに非常に身近な物質で、ホットケーキミックスに入っているベーキングパウダーや、ふくらし粉、重曹などにも含まれて物質。
水酸化ナトリウムには潮解性があり、その水溶液は、空気中の二酸化炭素を吸収するので、ある濃度の水溶液をつくるのも、その濃度を維持するのにも注意が必要である。
硫酸バリウムの中和
硫酸の分子式と電離では、硫酸の分子式が、H2SO4で、水溶液中での電離式は、H2SO4 → 2H+ + SO42-となり硫酸イオンという。
無色で、不揮発性の酸であり、三酸化硫黄という固体と水から生成したものなので、加熱しても気体は生じない。そのため、不揮発性の酸とされる。
濃硫酸は密度が大きく、水にとかすと発熱する。濃硫酸を水でうすめる場合は、冷却しながら水に徐々に濃硫酸を加える。濃硫酸には脱水性、吸湿性がある物質内にふくまれる水素原子と酸素原子を2:1の割合でとり去る性質を脱水性、物質にふくまれる水分をとり去る性質を吸湿性(吸水性)とよぶ。希硫酸(うすい硫酸)は強い酸性を示す。これに対して、濃硫酸はほとんど酸性を示さない。
塩化バリウム水溶液に加えると白色の沈殿を生じる白色の沈殿は硫酸バリウムである。硫酸バリウムは水に溶けにくい塩です。中和が起こった後は、電離して水に溶けている状態ではなく、むずびついて白い物質として沈殿します。硫酸と水酸化バリウム水溶液を完全に中和させると、水溶液中にはイオンがまったく存在しない状態になります。つまり、電流が流れなくなることも覚えておきましょう。
【対策問題】化学変化とイオンの定期テスト対策
【問1】次のア~カの化合物について、あとの問いに答えなさい。
エ:硫酸 オ:水酸化ナトリウム カ:エタノール
(1) 非電解質はどれか。ア~カのからすべて選びなさい。
(2) 水にとけたとき、電離して水酸化物イオンを生じるものを、ア~カのからすべて選びなさい。
(3) 電離して水酸化物イオンを生じる物質を何というか。
(4) 水にとけたとき、電離して水素イオンを生じるものを、ア~カのからすべて選びなさい。
(5) 電離して水素イオンを生じる物質を何というか。
(6) ア~カの水溶液に、緑色のBTB溶液をそれぞれ加えると、黄色になるものを、ア~カからすべて選びなさい。
(7) 水溶液にしたときに、pHが7よりも大きいものを、ア~カのからすべて選びなさい。
(8) ア~カの水溶液の2つを混ぜ合わせると、中和が起こった。この混合液を加熱して、水を蒸発させると、塩化ナトリウムの結晶が得られた。このとき、混ぜ合わせた水溶液の溶質はア~カのどれか。2つ選びなさい。
【問2】次の問いに答えなさい。
(1) 青色リトマス紙を赤色に変える水溶液は何性か。
(2) 青色・赤色のリトマス紙のどちらの色も変えない水溶液は何性か。
(3) 緑色のBTB 溶液を青色に変える水溶液は何性か。
(4) 酸性の水溶液にBTB溶液を加えると何色になるか。
(5) 酸性の水溶液にフェノールフタレイン溶液を加えると何色になるか。
(6) フェノールフタレイン溶液を赤色に変える水溶液は何性か。
(7) マグネシウムを入れると気体が発生する水溶液は何性か。
(8) 酸性のとき、発生する気体は何か。
(9) 次のア~ウのうち、酸性の水溶液はどれか。
ア水酸化ナトリウム水溶液 / イ塩化ナトリウム水溶液 / ウ塩酸
(10) 次のア~ウの水溶液のうち、赤色リトマス紙を青色に変える水溶液はどれか。
ア水酸化ナトリウム水溶液 / イ塩化ナトリウム水溶液 / ウ塩酸
(11) 水溶液にしたとき、酸性になる物質を何というか。
(12) 酸が水にとけたときに、何というイオンを生じるか。
(13) 水素イオンをイオン式で書きなさい。
(14) 水溶液にしたとき、アルカリ性になる物質を何というか。
(15) アルカリが水にとけたときに、何というイオンを生じるか。
(16) 水酸化物イオンのイオン式で書きなさい。
(17) 酸性やアルカリ性の強さを表す値を何というか。
(18) 中性のpHはいくつか。数字を答えなさい。
(19) アルカリ性のpHは、7の値よりも大きいか、小さいか答えなさい。
【問3】次の図のような装置で、塩化銅水溶液に電流を流した。これについて、次の問いに答えなさい。
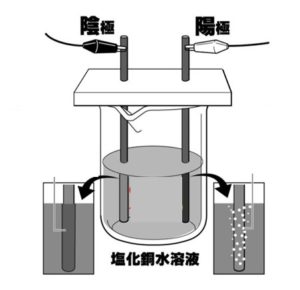
(1) 塩化銅水溶液は何色をしているか。次のア~ウから1つ選びなさい。
ア 赤色 イ 青色 ウ 無色
(2) しばらく電流を流していると、陰極の炭素棒の表面に赤色の物質が付着した。この物質は何か。化学式で書きなさい。
(3) 陽極の炭素棒の表面からは強い刺激臭のある気体が発生した。この気体は、塩化銅水溶液中の何イオンが変化したものか。イオン式で書きなさい。
(4) この装置で電流を流し続けていると、豆電球がしだいに暗くなってきた。この現象の原因として考えられることを、次のア~エから選び、記号で答えなさい。
ア 水溶液中のイオンの数がふえた。
イ 水溶液の量がふえた。
ウ 水溶液中のイオンの数が減った。
エ 水溶液の量が減った。
(5) 塩化銅のように、水にとけたときにイオンに分かれ、電流を流すことができる物質を何というか。
【解答・解説】化学変化とイオンの定期テスト対策
【問1】の解答
(1) カ
(2) ウ・オ
(3) アルカリ
(4) ア・エ
(5) 酸
(6) ア・エ
(7) ウ・オ
(8) ア・オ
【問2】の解答
(1) 酸性
・青色リトマス紙を赤色に変える。
・緑色のBTB溶液を黄色に変える。
・マグネシウムを入れると、水素が発生する。
(2) 中性
(3) アルカリ性
・赤色リトマス紙を青色に変える。
・緑色のBTB溶液を青色に変える。
・フェノールフタレイン溶液を赤色に変える。
(4) 黄色
(5) 無色(のまま) 水
(6) アルカリ性
アルカリ水溶液にしたとき、電離して水酸化物イオン(OH)を生じる物質。(例)水酸化ナトリウム,水酸化カルシウム, アンモニアなど。
(7) 酸性
(8) 水素
(9) ウ
(10) ア
(11) 酸
(12) 水素イオン
(13) H+
(14) アルカリ
(15) 水酸化物イオン
(16) OH–
(17) pH
(18) 7
(19) 大きい
【問3】
(1)イ
(2)Cu
(3)Cl–
(4)ウ
(5)電解質


コメント